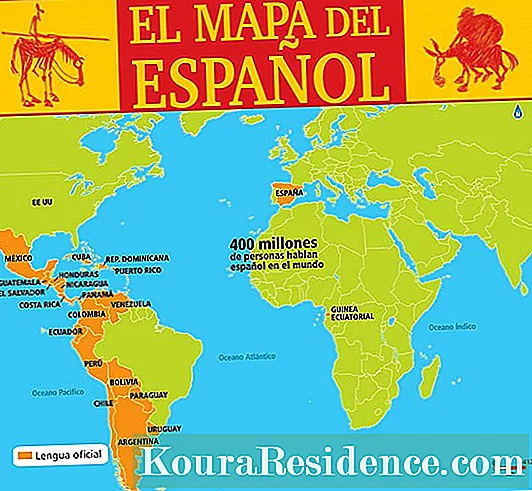
को अणुहरु को गठन गर्न रासायनिक यौगिकहरु, बिभिन्न पदार्थ वा तत्वहरु का परमाणुहरु एक अर्का संग एक स्थिर तरीका मा जोड्नु पर्छ, र यो विभिन्न परम्परागत विशेषताहरु को आधार मा हुन सक्छ कि प्रत्येक परमाणु छ, जुन, जसरी हामी जान्दछौं, एक सकारात्मक चार्ज न्यूक्लियस इलेक्ट्रोन को बादलले घेरिएको हुन्छ।
इलेक्ट्रोन नकारात्मक चार्ज गरीन्छ र नाभिकको नजिक रहन्छ किनभने विद्युत चुम्बकीय बल उनीहरुलाई आकर्षित गर्दछ। एक इलेक्ट्रोन नाभिक को नजिक छ, यो रिलीज को लागी प्राप्त गर्न को लागी अधिक ऊर्जा को आवश्यकता छ।
तर सबै तत्वहरु उस्तै छैनन्: केहि को बादल को बाहिरी इलेक्ट्रोन (कम आयनीकरण ऊर्जा संग तत्वहरु) गुमाउने प्रवृत्ति छ, जबकि अरु उनीहरु लाई कब्जा गर्न को लागी हुन्छन् (उच्च इलेक्ट्रोन आत्मीयता संग तत्वहरु)। यो हुन्छ किनभने लुईस अक्टेट नियम अनुसार, स्थिरता बाहिरी शेल वा कक्षमा elect इलेक्ट्रोन को उपस्थिति संग सम्बन्धित छ, कम से कम ज्यादातर अवस्थामा।
त्यसपछि कसरी त्यहाँ हानि वा इलेक्ट्रोन को लाभ हुन सक्छ, विपरीत चार्ज को आयनहरु गठन गर्न सकिन्छ, र विपरीत चार्ज को आयनहरु को बीच इलेक्ट्रोस्टैटिक आकर्षण यी मिल्छ र साधारण रासायनिक यौगिकहरु बनाउँछ, जसमा एक तत्वले इलेक्ट्रोन दिए र अर्को उनीहरुलाई प्राप्त भयो। ताकि यो हुन सक्छ र a आयनिक बन्धन यो आवश्यक छ कि त्यहाँ एक फरक वा कम से कम १. involved को तत्वहरु को बीच विद्युतीय ofणात्मकता को डेल्टा हो।
को आयनिक बन्धन सामान्यतया एक धातु यौगिक र एक गैर धातु एक को बीच हुन्छ: धातु परमाणु एक वा धेरै इलेक्ट्रोनहरु दिन्छ र फलस्वरूप सकारात्मक चार्ज आयनहरु (cations), र nonmetal लाभ र नकारात्मक चार्ज कण (आयन) बन्छ। क्षार र क्षारीय पृथ्वी धातुहरु तत्वहरु हुन् कि सबैभन्दा धेरै cations गठन गर्न को लागी हुन्छन्, र हलोजन र अक्सिजन सामान्यतया anions छन्।
सामन्यतया, यौगिकहरु कि आयनिक बांड द्वारा बनाईएको हो छन् कोठा को तापमान र उच्च पिघ्ने बिन्दु मा ठोस, पानी मा घुलनशील। समाधान मा उनीहरु धेरै छन् बिजुली को राम्रो कन्डक्टरकिनकि उनीहरु बलियो इलेक्ट्रोलाइट्स हुन्। एक आयनिक ठोस को जाली ऊर्जा के हो कि ठोस को आयनहरु बीच आकर्षक बल चिन्ह लगाउँछ।
यो तपाइँ सेवा गर्न सक्नुहुन्छ:
- सहसंयोजक बांड को उदाहरण
- म्याग्नेशियम अक्साइड (MgO)
- कपर सल्फेट (CuSO4)
- पोटेशियम आयोडाइड (KI)
- जिंक हाइड्रोक्साइड (Zn (OH) २)
- सोडियम क्लोराइड (NaCl)
- चाँदी नाइट्रेट (AgNO3)
- लिथियम फ्लोराइड (LiF)
- म्याग्नेशियम क्लोराइड (MgCl2)
- पोटेशियम हाइड्रोक्साइड (KOH)
- क्याल्सियम नाइट्रेट (Ca (NO3) २)
- क्याल्सियम फास्फेट (Ca3 (PO4) २)
- पोटेशियम डाइक्रोमेट (K2Cr2O7)
- डिसोडियम फास्फेट (Na2HPO4)
- फलाम सल्फाइड (Fe2S3)
- पोटेशियम ब्रोमाइड (KBr)
- क्याल्सियम कार्बोनेट (CaCO3)
- सोडियम हाइपोक्लोराइट (NaClO)
- पोटेशियम सल्फेट (K2SO4)
- मैंगनीज क्लोराइड (MnCl2)